


1,項(xiàng)目概況
現(xiàn)有 xxx 公司的激光產(chǎn)品于 08/24/2020 被 FDA 列入 DWPE 名單。由于 改名單與海關(guān)進(jìn)口警報(bào)聯(lián)通,企業(yè)出口到美國(guó)的激光產(chǎn)品將被無條件扣留。 DWPE 為 Divisions may detain without physical examination 的簡(jiǎn)稱,即 由于企業(yè)之前的違法行為被列入了 RED LIST,海關(guān)可在不經(jīng)驗(yàn)證的情況下扣 留在改名單內(nèi)企業(yè)的產(chǎn)品。 現(xiàn)需經(jīng)過有效的方案,準(zhǔn)備相關(guān)資料并與 FDA 進(jìn)行申請(qǐng)和溝通,將企 業(yè)從 DWPE 中移除。
2,項(xiàng)目方案與計(jì)劃
由于 DWPE 產(chǎn)生的原因是 FDA 核查到企業(yè)激光產(chǎn)品有違規(guī)的情況,并經(jīng) 過通知后企業(yè)未進(jìn)行進(jìn)一步改善或解釋,所以直接將企業(yè)列入了 red list。
所以,本次項(xiàng)目的服務(wù)內(nèi)容將由如下步驟進(jìn)行:
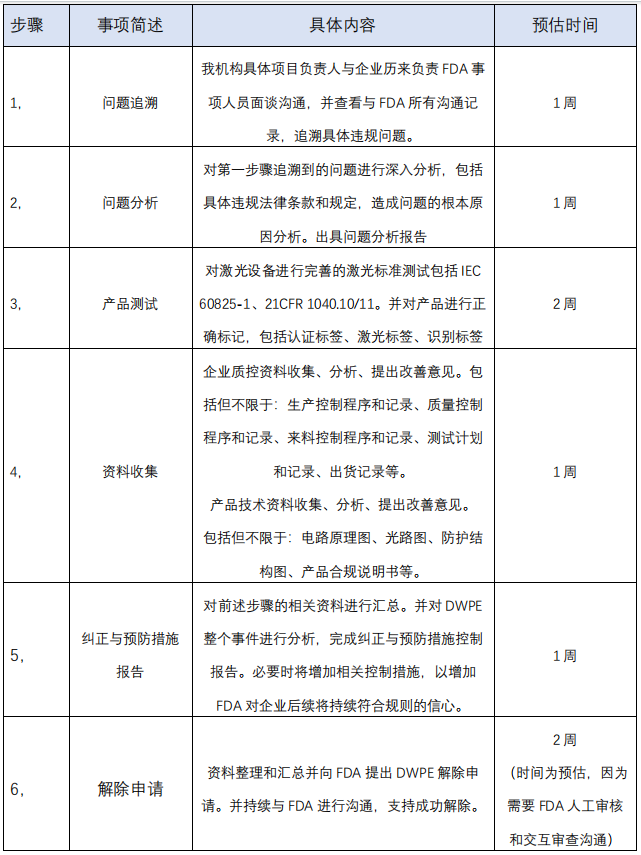
1, 與企業(yè)歷來進(jìn)行 FDA 認(rèn)證注冊(cè)的人員進(jìn)行溝通,查閱與 FDA 往來 的所有相關(guān)信息,追溯具體違規(guī)事項(xiàng)。
2, 對(duì)違規(guī)事項(xiàng)進(jìn)行深入分析,包括但不限于造成問題的原因,原因可 改善空間分析等。
3, 對(duì)產(chǎn)品進(jìn)行完善的激光標(biāo)準(zhǔn)測(cè)試,并確保測(cè)試結(jié)果合格。
4, 從新對(duì)企業(yè)資料和產(chǎn)品技術(shù)資料進(jìn)行收集(必要是問題改善),包 括但不限于:生產(chǎn)質(zhì)量控制資料、檢測(cè)和出貨記錄、產(chǎn)品技術(shù)資料 等各方面。
5, 對(duì)上述的分析、測(cè)試、生產(chǎn)和技術(shù)資料進(jìn)行匯總。與第一條追溯到 的違規(guī)問題對(duì)應(yīng),編制完整的糾正措施與預(yù)防控制報(bào)告。
6, 開始與 FDA 溝通,申請(qǐng)解除 DWPE。
7, FDA 可能提出改善和分析資料的補(bǔ)正要求,依據(jù) FDA 要求進(jìn)一步 進(jìn)行補(bǔ)充。
8, 解除 DWPE。
3,服務(wù)內(nèi)容和時(shí)間計(jì)劃

返回頂部